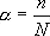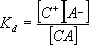|
?????? ?? ???????????? ??????????
|
|
||||
|
Степен на електролитна дисоциация Електролитната дисоциация е обратим процес. Във всеки момент във водния разтвор на електролитите има йони, както и молекули. Между тези две форми се установява динамично химично равновесие ( скоростта на правата реакция (дисоциация) е равна на скоростта на обратната (моларизация). Степента на електролитната дисоциация * се представя чрез:
Където: n – броя молекули, дисоциирани на йони ; N – общия брой на молекулите на разтвореното вещество. Когато n=N степента на дисоциация 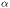 =1. В този случай всички молекули от разтвореното вещество са дисоциирани на йони. Когато n=0 веществото не се дисоциира на йони: това е един не-електролит. Стойностите на степента на дисоциация варират между 0 и 1 ( 0 - 100%). =1. В този случай всички молекули от разтвореното вещество са дисоциирани на йони. Когато n=0 веществото не се дисоциира на йони: това е един не-електролит. Стойностите на степента на дисоциация варират между 0 и 1 ( 0 - 100%). Степента на електролитна дисоциация зависи от природата на електролита и от концентрацията на разтвора. Според стойността на 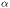 електролитите са разделени на слаби електролити ( електролитите са разделени на слаби електролити (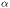 < 5%) и силни ( < 5%) и силни (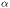 > 5%). Експерименталната степен на дисоциация на силните електролити не позволява да се съди за тяхната реална дисоциация и се нарича привидна степен на дисоциация.Нейната стойност е винаги по-малка от тази на истинската степен на дисоциация. Успоредно с нарастване на концентрацията на разтвора на един силен електролит се наблюдава нарастване на привличането между йоните с противоположни заряди. Някои от тези йони, които са се доближили достатъчно, формират двойки йони. Тези двойки, без да са отделни молекули, се държат като такива. > 5%). Експерименталната степен на дисоциация на силните електролити не позволява да се съди за тяхната реална дисоциация и се нарича привидна степен на дисоциация.Нейната стойност е винаги по-малка от тази на истинската степен на дисоциация. Успоредно с нарастване на концентрацията на разтвора на един силен електролит се наблюдава нарастване на привличането между йоните с противоположни заряди. Някои от тези йони, които са се доближили достатъчно, формират двойки йони. Тези двойки, без да са отделни молекули, се държат като такива.
По-практично е да се характеризира склонността на един електролит да се дисоциира в разтвора с помощта на константата на дисоциация (тя е независима от концентрацията на разтвора). В случай на разтвор на слаб електролит ( 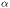 <<1) може да се говори за съществуване на равновесие между йоните и молекулите: <<1) може да се говори за съществуване на равновесие между йоните и молекулите:
CA  C+ + A- C+ + A-
Kd = константа на дисоциация на слаб електролит.
|