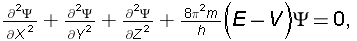|
????????? ?? ??????????
|
|
|
|
Уравнение на Шрьодингер
Вълновите функции не са достъпни за никакво експериментално определяне; те могат единствено априори да бъдат изчислени. Те се получават като решение на едно диференциално уравнение, наречено уравнение на Шрьодингер:
E: пълната енергия на електрона
V: потенциалната енергия на електрона m: масата на електрона h : константа на Планк Решенията на това уравнение трябва да отговарят на определен брой условия: функцията 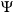 трябва да бъде единствена, крайна и непрекъсната по отношение на x, y и z ; тя трябва освен това да задоволява условието, изразено от уравнението по-горе. трябва да бъде единствена, крайна и непрекъсната по отношение на x, y и z ; тя трябва освен това да задоволява условието, изразено от уравнението по-горе.В резултат на това уравнението на Шрьодингер има решения единствено за определени стойности на енергията, наречени характерни стойности. За водородния атом, характерните стойности на енергията са дадени чрез зависимостта: 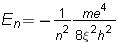 където: m и e са масата и заряда на електрона където: m и e са масата и заряда на електрона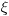 : диелектричната проницаемост на вакуум : диелектричната проницаемост на вакуум h : константата на Планк n е число, което може да заема стойности 1, 2, 3, и т.н. Това число се идентифицира с главното квантово число, присъстващо в модела на Бор. В математическото определяне на вълновата функция се получават и другите две квантови числа l и m. Уравнението на Шрьодингер не може да бъде решено освен за системи с един единствен електрон: водород и водородоподобни йони като He+ или Li2+ . Когато има повече електрони ситуацията е много по-комплексна тъй като освен взаимодействието ядро-електрон (привличане с ядрото), се появяват взаимодействия електрон – електрони (ефекти на отблъскване между електроните) които зависят от позициите на двете частици: ВЪЛНОВА ФУНКЦИЯ ЗА ПОВЕЧЕ ЧАСТИЦИ Решенията на уравнението на Шрьодингер, независими от времето, са квантовите състояния, описващи едновременно електроните. Те са описани математически от една “многоелектронна” вълнова функция, зависеща от пространствените координати и от спина на Z електрона. След опростявания тя се отбелязва като се взима предвид само броя на електроните: 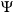 (1, 2, ..., З) (1, 2, ..., З)Няма познато аналитично решение на съответното уравнение на Шрьодингер. Търсят се близки решения, които не са само математически, но съдържащи в себе си разглежданите концепции и са приложими независимо от разглеждания атом. |