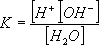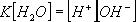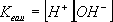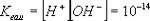|
????? ???????????? ?? ??????. pH
|
|
||||||||
|
Йонно произведение на водата. pH
Молекулите на водата са слабо дисоциирани на йони: H2O  H+ + OH- H+ + OH-Равновесната константа е:
или
Тъй като само една малка част от водата се дисоциира на йони, може да се приеме че нейната концентрация е непроменлива и постоянна . Имаме:
Тази величина се нарича йонно произведение на водата. При 25°C Kвода = 10-14 .
Тъй като:
в процеса на дисоциацията на водата [H+] = [OH-], йонното произведение на водата се представя под формата : [H+]2 = 10-14 ; откъдето [H+] = [OH-]= 10-7 .
Концентрацията на водородните йони във воден разтвор на електролит може да бъде изразена чрез концентрацията на хидроксидните йони и обратно: [H+] = 10-14 / [OH-] или [OH-]= 10-14 / [H+].
Отрицателния десетичен логаритъм от концентрацията на водородните йони се нарича pH: pH = -lg [H+].
Характера на средата, изразен чрез pH може да бъде изразен както следва: pH = 7 – неутрална среда; pH < 7 – кисела среда; pH > 7 – алкална среда. Стойността на pH на един разтвор може да бъде измерена, използвайки индикатори за pH (индикаторна хартия за pH) и pH-метър. |